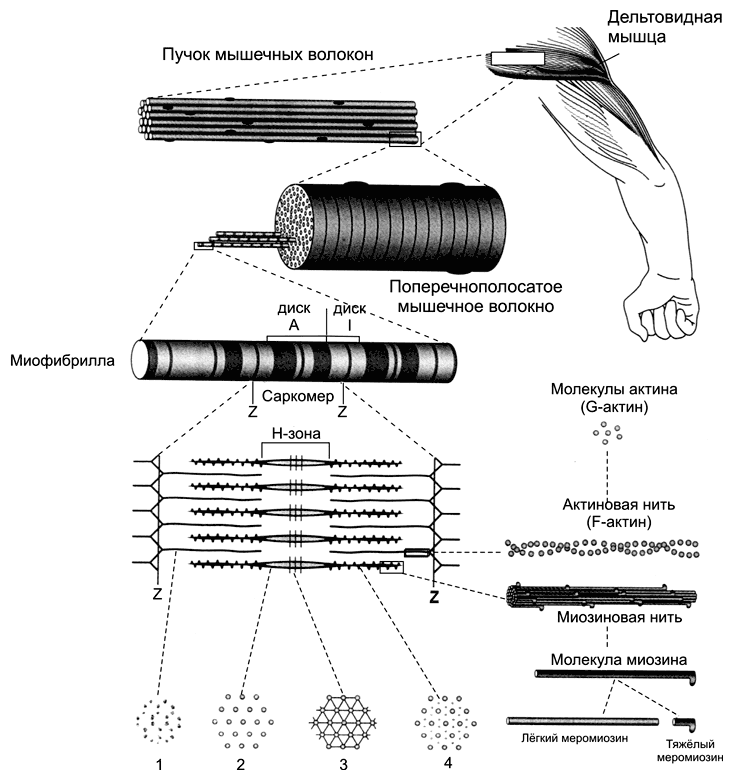
 Каждая миофибрилла содержит около 1500 толстых и 3000 тонких нитей. Поперечная исчерченность скелетного мышечного волокна (рис. 7-1) определяется регулярным чередованием в миофибриллах различно преломляющих поляризованный свет участков (дисков) — изотропных и анизотропных: светлые диски (Isotropic, I–диски) и тёмные диски (Anisotropic, А–диски).
Каждая миофибрилла содержит около 1500 толстых и 3000 тонких нитей. Поперечная исчерченность скелетного мышечного волокна (рис. 7-1) определяется регулярным чередованием в миофибриллах различно преломляющих поляризованный свет участков (дисков) — изотропных и анизотропных: светлые диски (Isotropic, I–диски) и тёмные диски (Anisotropic, А–диски).
Рис. 7-1. Скелетная мышца состоит из поперечнополосaтых мышечных волокон [11]. Значительный объём мышечных волокон занимают миофибриллы. Расположение светлых и тёмных дисков в параллельных друг другу миофибриллах совпадает, что приводит к появлению поперечной исчерченности. Структурная единица миофибрилл — саркомер, сформированный из толстых (миозиновых) и тонких (актиновых) нитей. Расположение тонких и толстых нитей в саркомере показано слева и слева внизу. G?актин — глобулярный, F?актин — фибриллярный актин.
Разное светопреломление дисков определяется упорядоченным расположением по длине саркомера тонких нитей (актиновых) и толстых нитей (миозиновых).
Толстые нити находятся только в тёмных дисках, светлые диски не содержат толстых нитей. Каждый светлый диск пересекает Z-линия.
Участок миофибриллы между соседними Z-линиями определяют как саркомер.
Саркомер
Саркомер — часть миофибриллы, расположенная между двумя последовательными Z–дисками. В состоянии покоя и полностью растянутой мышце длина саркомера составляет 2 мкм. При такой длине саркомера актиновые (тонкие) нити лишь частично перекрывают миозиновые (толстые) нити. Один конец тонкой нити прикреплён к Z-линии, а другой конец направлен к середине сaркомера.
Толстые нити занимают центральную часть сaркомера — А–диск (содержащий только толстые нити участок сaркомера — Н-зона, в середине Н-зоны проходит М-линия). I–диск входит в состав двух сaркомеров. Следовательно, каждый сaркомер содержит один А–диск (тёмный) и две половины I–диска (светлого), формула саркомера — 0,5А + I + 0,5А. Во время сокращения длина A–диска не меняется, а I–диска — укорачивается, что и послужило основанием для создания теории, объясняющей сокращение мышцы механизмом скольжения (теория скольжения) тонких актиновых нитей вдоль толстых миозиновых.
Толстая нить
Толстая нить представлена на рис 7-3Б. Каждая миозиновая нить состоит из 300–400 молекул миозина и С?белка.
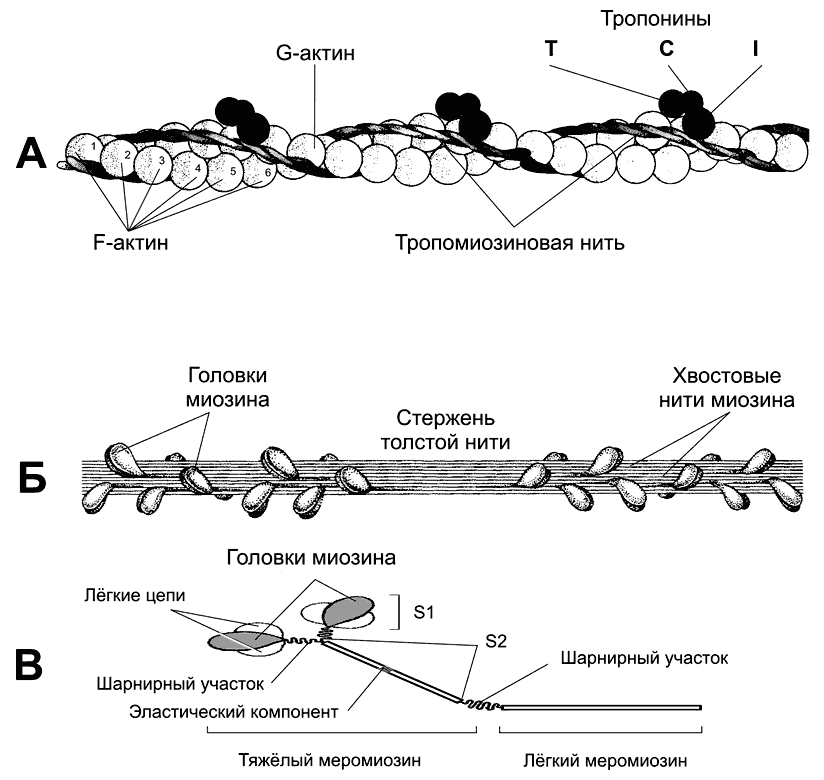
Рис. 7-3. Тонкая и толстая нити в составе миофибрилл [11]. А. Тонкая нить — две спирально скрученные нити фибриллярного актина (F?актин). В канавках спиральной цепочки залегает двойная спираль тропомиозина, вдоль которой располагаются молекулы тропонина трёх типов. Б — толстая нить. Молекулы миозина способны к самосборке и формируют веретенообразный агрегат диаметром 15 нм и длиной 1,5 мкм. Фибриллярные хвосты молекул образуют стержень толстой нити, головки миозина расположены спиралями и выступают над поверхностью толстой нити. В — молекула миозина. Лёгкий меромиозин обеспечивает агрегацию молекул миозина, тяжёлый меромиозин имеет связывающие актин участки и обладает активностью АТФазы.
Миозин (рис 7-3В) — гексaмер (две тяжёлые и четыре лёгкие цепи). Тяжёлые цепи — две спирально закрученные полипептидные нити, несущие на своих концах глобулярные головки. В области головок с тяжёлыми цепями ассоциированы лёгкие цепи. Каждую миозиновую нить связывает с Z–линией гигантский белок титин. С толстыми нитями ассоциированы небулин, миомезин, креатинфосфокиназа и другие белки.
В молекуле миозина (рис. 7-3В), мол. масса 480 000, различают тяжёлый и лёгкий меромиозин. Тяжёлый меромиозин содержит субфрагменты (S): S1 содержит глобулярные головки миозина, S2 — прилежащую к головкам часть фибриллярного хвоста молекулы миозина. S2 эластичен (эластический компонент S2), что допускает отхождение S1 на расстояние до 55 нм. Концевую часть хвостовой нити миозина длиной 100 нм образует лёгкий меромиозин.
Миозин имеет два шарнирных участка, позволяющих молекуле изменять конформацию. Один шарнирный участок находится в области соединения тяжёлого и лёгкого меромиозинов, другой — в области шейки молекулы миозина (S1—S2–соединение).
Половина молекул миозина обращена головками к одному концу нити, а вторая половина — к другому (рис. 7-3Б). Лёгкий меромиозин лежит в толще толстой нити, тогда как тяжёлый меромиозин (благодаря шарнирным участкам) выступает над её поверхностью.
Титин — наибольший из известных полипептидов с мол. массой 3000 кД — наподобие пружины связывает концы толстых нитей с Z-линией. Другой гигантский белок — небулин (Mr 800 кД) — ассоциирует тонкие и толстые нити.
С?белок стабилизирует структуру миозиновых нитей. Влияя на агрегацию молекул миозина, обеспечивает одинаковый диаметр и стандартную длину толстых нитей.
Миомезин (М?белок) и креатинфосфокиназа — белки, ассоциированные с толстыми нитями в середине тёмного диска. Креатинфосфокиназа способствует быстрому восстановлению АТФ при сокращении. Миомезин выполняет организующую роль при сборке толстых нитей.
Тонкая нить
Тонкая нить (рис 7-2А) имеет длину около 1 мкм и состоит из двойной спирали F-актина в кооперации с двумя нитями тропомиозина, белков тропонинового комплекса и ассоциированных с тонкой нитью и образующих её поддерживающий каркас альфа-актинина, десмина и небулина.
Актин. Молекулы глобулярного актина (G-актин, мол. масса 45 000) полимеризуются и образуют фибриллярный актин (F— актин). С одним из G-актинов связана молекула АДФ; считается, что именно этот место — активный участок, где происходит взаимодействие с головкой миозина.
Тропомиозин. Молекулы имеют мол. массу 70 000 и длину 40 нм и укладываются конец в конец в желобке между двумя спирально закрученными цепочками F-актина. В состоянии покоя молекулы тропомиозина «закрывают» активные участки актино-вых нитей и предотвращают взаимодействие актина и миозина.
Тропонины. Этот комплекс прикреплён к молекулам тропомиозина с интервалами 40 нм и образован 3 глобулярными субъединицами — тропонинами Т (связывается с тропомиозином), I (препятствует взаимодействию актина и миозина) и С (Са2+-связывающий белок).
Альфа-актинин, десмин и виментин — белки, ассоциированные с тонкими нитями; они входят в состав Z-линии, в которую вплетён один конец тонкой нити; второй конец расположен между толстыми нитями и ассоциирован с ними при помощи небулина.
Орлов Р.С., Ноздрачёв А.Д. Нормальная физиология : Учебник. - М.: ГЭОТАР-Медиа, 2009. – 688 с. Глава 7. Физиология сократительных элементов. - Скелетная мышца. – Миофибриллы. - С. 96-98.