 Саркоплазма содержит обильную эндоплазматическую сеть (саркоплазматический ретикулум — СР, рис. 7-2).
Саркоплазма содержит обильную эндоплазматическую сеть (саркоплазматический ретикулум — СР, рис. 7-2).
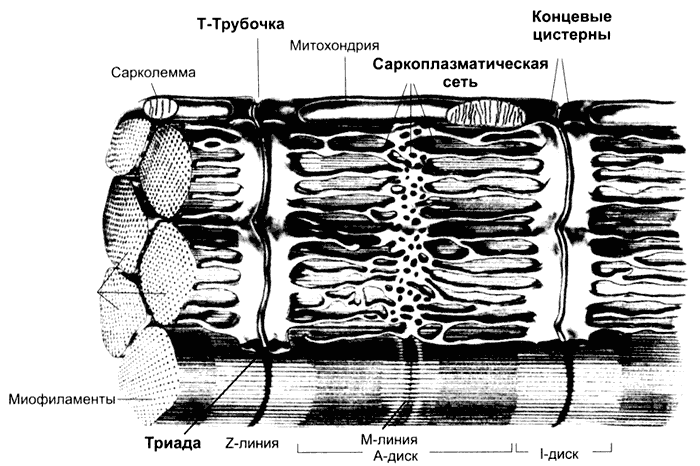
Рис. 7-2. Фрагмент скелетного мышечного волокна [11]. Цистерны саркоплазматического ретикулума окружают каждую миофибриллу. Т-трубочки подходят к миофибриллам на уровне границ между тёмными и светлыми дисками и вместе с концевыми цистернами СР образуют триады.
Cаркоплазматический ретикулум имеет вид канальцев, идущих преимущественно вдоль миофибрилл и анастомозирующих друг с другом. В каждом саркомере саркоплазматический ретикулум образует расширенные участки — концевые цистерны.
Между двумя соседними концевыми цистернами располагается Т-трубочка — впячивание сарколеммы. Этот комплекс (две концевые цистерны и Т-трубочка) называется «триадой». В триадах происходит передача возбуждения в виде ПД плазматической мембраны мышечного волокна на мембраны концевых цистерн — сопряжение возбуждения и сокращения (электромеханическое сопряжение): дигидропиридиновые рецепторы Т-трубочек регистрируют изменения МП (dV) и активируют рианодиновые рецепторы саркоплазматического ретикулума (Са2+-канал).
Cаркоплазматический ретикулум — модифицированная гладкая эндоплазматическая сеть — выполняет функцию депо кальция. Са2+-транспортируюшие АТФазы СР откачивают ионы кальция из саркоплазмы. Са2+-связываю-щий белок кальсеквестрин находится внутри СР. Кальциевые каналы, образованные рецепторами рианодина, высвобождают Са2+ из депо в саркоплазму.
Депо Са2+ (рис. 7-4А). Цистерны гладкой эндоплазматической сети многих клеток специализированы для накопления в них Са2+ путём постоянного откачивания Са2+ из цитоплазмы. Подобные депо существуют в скелетной и сердечной мышцах, нейронах, хромаффинных клетках, яйцеклетке, эндокринных клетках.
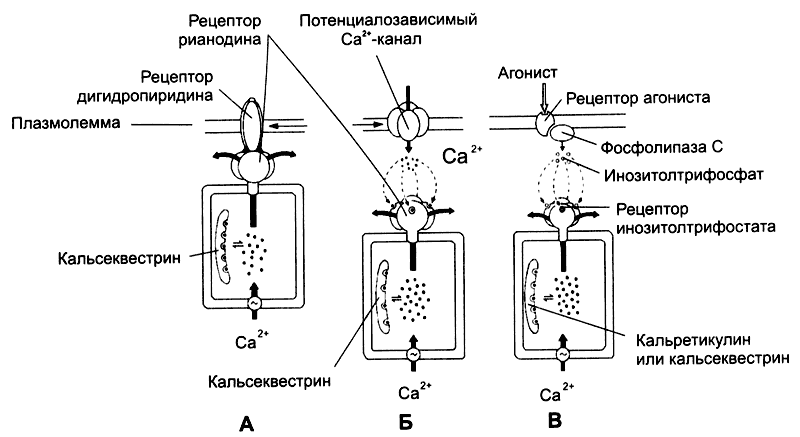
Рис. 7-4. Механизм высвобождения Са2+ из цистерн саркоплазматического ретикулума [11]. Рецептор рианодина в мембране цистерны связан с Са2+-каналом. Работу канала контролируют рецепторы дигидропиридина плазмолеммы (А), в ответ на деполяризацию активирующие рецепторы рианодина, что и приводит к высвобождению Са2+; Б — рецептор рианодина в мембране цистерны непосредственно не связан с белками плазмолеммы, но активируется Са2+ при незначительном повышении концентрации этого катиона в цитозоле за счёт поступления в клетку через потенциалозависимые Са2+-каналы; В — Са2+ освобождается из цистерн при активации рецепторов ИТФ. Этот второй посредник образуется при участии фосфолипазы С в ответ на взаимодействие агониста со своим рецептором в плазмолемме.
Различные сигналы (например, гормоны, нейромедиаторы, факторы роста) влияют на активность клеток и их пролиферацию путём изменения концентрации внутриклеточного посредника — Са2+. Например, условием сокращения мышечных элементов является резкое повышение концентрации Са2+ в цитозоле. Для этого необходимо накопление Са2+ в специальных депо, образованных Са2+-запасающими цистернами СР. Внутри цистерн находятся Са2+-связывающие белки. В мембрану цистерн-депо Са2+ встроены Са2+-насос и Са2+-канал. Цистерны содержат также низкомолекулярные фосфопротеины, регулирующие захват Са2+ (например, фосфоламбан СР ГМК и сердечной мышцы).
Са2+-связывающие белки внутри цистерн (кальсеквестрин, кальретикулин и др.) непрочно ассоциированы с Са2+. Кальсеквестрин — главный Са2+-связывающий белок СР волокон поперечнополосатой мышцы и некоторых ГМК. Одна молекула кальсеквестрина связывает приблизительно 50 ионов Са2+. Кальретикулин присутствует в СР большинства ГМК и в эндоплазматическом ретикулуме немышечных клеток.
Са2+-насос, закачивающий Са2+ внутрь цистерн — Са2+-АТФаза.
Са2+-канал, по которому Са2+ выходит из цистерны в цитозоль по градиенту концентрации. Известно несколько типов Са2+-каналов, в том числе управляемые рецепторами рианодина и ИТФ.
Рецепторы рианодина активируются двояко: через рецепторы дигидропиридина и через потенциалозависимые Са2+-каналы.
Рецепторы дигидропиридина встроены в клеточную мембрану и реагируют на изменения МП: изменение их конформации активирует рецепторы рианодина и приводит к высвобождению Са2+ из депо (рис. 7-4Б). Подобный механизм функционирует в скелетных MB.
Изменения мембранного потенциала открывают потенциалозависимые Са2+-каналы, в клетке незначительно повышается концентрация Са2+. Этот Са2+ активирует рецепторы рианодина, и запасённый в депо Са2+ выходит в цитозоль. Такой механизм функционирует в нейронах и кардиомиоциmax.
Кофеин также может открывать Са2+-каналы, активируя рецепторы рианодина, но в то же время кофеин — мощный ингибитор рецепторов ИТФ, что нивелирует его эффект на рецепторы рианодина.
Инозитолтрифосфат. Каналы в мембране цистерн открываются под действием ИТФ (рис. 7-4В), образующегося при воздействии на клетку внешнего сигнала. Так, при взаимодействии ангиотензина со своим рецептором в плазматической мембране ГМК активируется фосфолипаза С и образуется ИТФ. Последний диффундирует в цитоплазме, связывается с рецепторами ИТФ в мембране цистерн гладкой эндоплазматической сети и открывает Са2+-каналы. Этот механизм функционирует в овоцитах, лимфоцитах, ГМК и других клетках.
Орлов Р.С., Ноздрачёв А.Д. Нормальная физиология : Учебник. - М.: ГЭОТАР-Медиа, 2009. – 688 с. Глава 7. Физиология сократительных элементов. - Скелетная мышца. - Саркоплазматическая сеть и Т-трубочки. - С. 98-101.